【文章内容】
我们以典型的三氟甲磺酸锌(Zn(OTf)2)和7种常见的助溶剂为例,用密度泛函理论(DFT)分析了纯水为隐性溶剂下的阳离子偶极子(Zn2+-助溶剂)相互作用和不同混合溶剂为隐性溶剂下的离子对(Zn2+-OTf-)相互作用,发现通过引入介电常数比H2O高的助溶剂可以减弱Zn2+与OTf-之间的相互作用。随后,通过分子动力学(MD)模拟分析了引入相同体积的不同助溶剂对Zn2+第一溶剂化壳层的影响,定量分析了引入助溶剂引起的溶剂化结构与动力学的差异,从而建立了溶剂化结构与动力学性能之间的关系。最后,实验表明,所提出的共溶剂电解质策略可以在提高AZBs电化学性能的同时实现动力学补偿(KC)。基于KC机理设计的共溶剂电解质在5 mA cm–2下对Zn/Zn电池实现了4000 h的稳定循环,对Zn/Cu电池实现了3000次循环。采用合成正极(K+掺杂的钒酸铵,KNVO)和商业正极(Li2.5V2(PO4)3,LVP)的全电池均表现出了改善的电化学性能。即使在低N/P比3.8和低电流密度0.1 A g–1的极端条件下,Zn/LVP电池在200次循环中仍然可以实现80.4%的高容量保持率。该成果以题为“Kinetics Compensation Mechanism in Cosolvent Electrolyte Strategy for Aqueous Zinc Batteries”发表在国际知名期刊Journal of the American Chemical Society上,第一作者为博士生丛建龙。
【研究背景】
水系锌电池(AZB)由于Zn具有较高的理论容量和相对较低的氧化还原电位、高安全性和低成本,是实现本质安全储能的理想选择。然而,锌枝晶和寄生副反应,如析氢反应(HER)和腐蚀,使其在实践中难以实现。为了应对这些挑战,人们投入了大量精力进行电解质优化,界面涂层,隔膜改性,以及宿主材料设计。具体来说,共溶剂电解质通过调节溶剂化结构、重建氢键网络和优化电极/电解质界面处的双电层(EDL),有效地抑制了锌枝晶并减轻了意外的副反应。然而,共溶剂通常比H2O分子更大、粘度更大,迁移速度更慢,因此通常会造成不可避免的动力学损失。此外,多价离子(如Zn2+和Al3+)的临界离子对距离大于单价离子(如Li+和Na+)的临界离子对距离,这意味着多价离子更容易形成阴离子-阳离子对,因此会遭受动力学损失。溶剂分子屏蔽离子间库仑引力的有效性与其介电常数密切相关。因此,对于共溶剂电解液,可以通过提高混合溶剂的介电常数来增大临界离子对距离,减弱阴阳离子对相互作用。而且,高介电常数的共溶剂可以与Zn2+形成阳离子偶极相互作用,调节电解液的溶剂化结构,从而增加Zn2+的迁移数。减弱阴离子阳离子对相互作用,增加电解液的Zn2+迁移数,可以实现动力学补偿。
【研究亮点】
与单纯降低对电解液中Zn2+扩散系数的影响的传统策略不同,动力学补偿机制主要通过以下两个方面实现:(1)削弱Zn2+与阴离子之间的库仑相互作用;(2)提高Zn2+的迁移数。
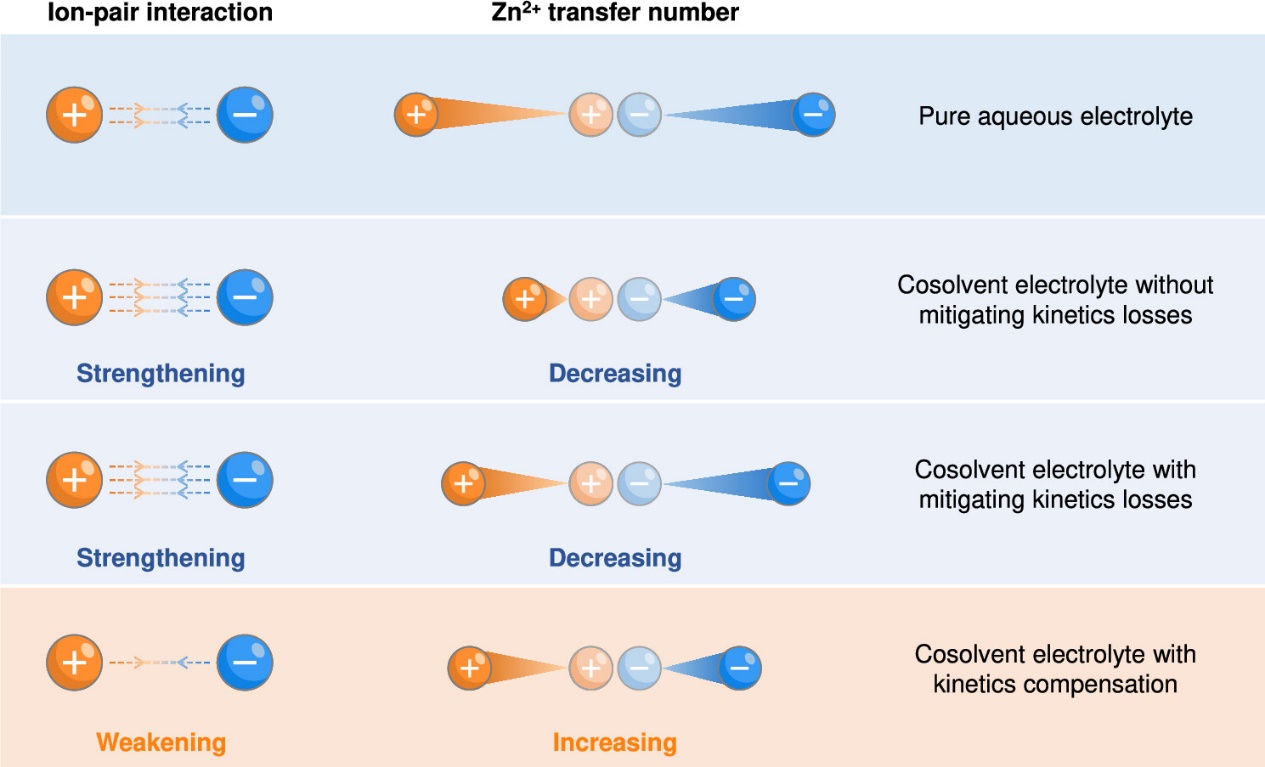
动力学补偿机制示意图与其他共溶剂电解液策略对比的机理示意图
【图文导读】
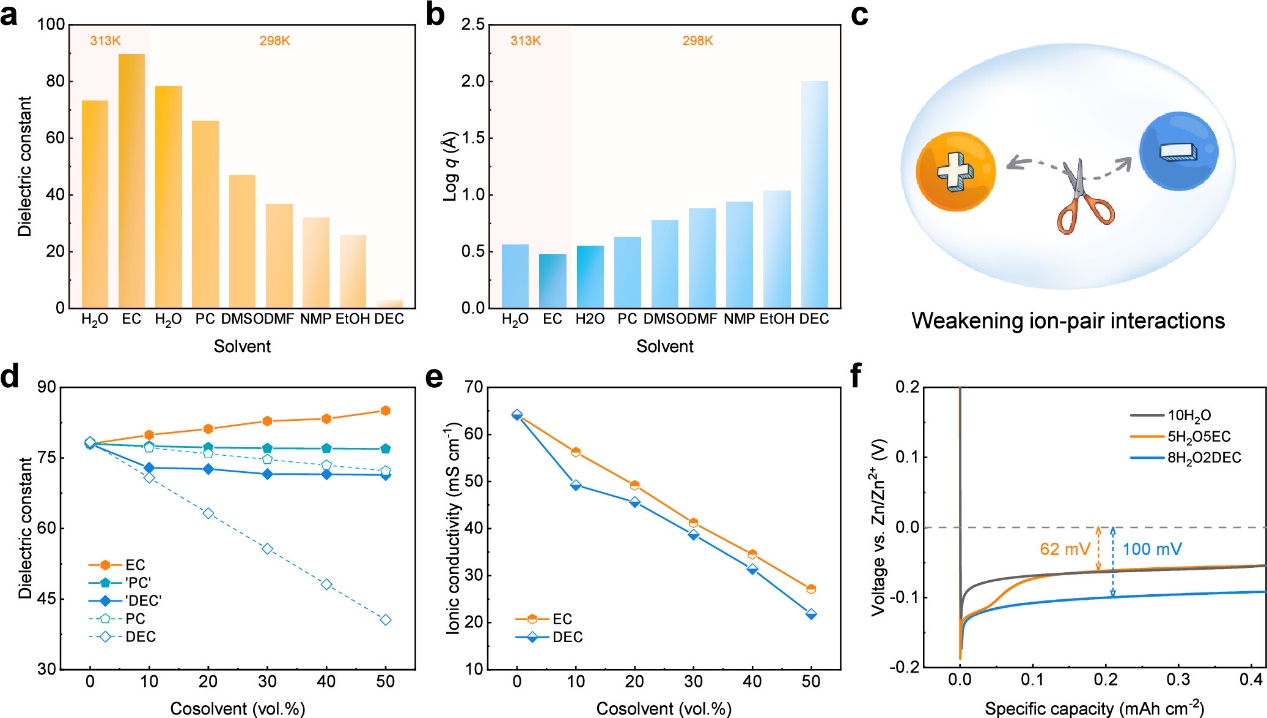
图1. 溶剂的差异。(a)不同溶剂的介电常数。(b)基于单价离子盐在不同溶剂中的临界离子对形成距离。(c)削弱离子对相互作用的示意图。(d)加入不同共溶剂后的水系溶剂的介电常数。虚线代表理论值。(e)2.0 M Zn(OTf)2在不同共溶剂中的离子电导率。(f)在不同电解液中,锌在铜片上以1.0 mA cm-2电流密度沉积的电压曲线。
在所研究的共溶剂体系中,仅当添加EC时,混合水系溶剂的介电常数才会显著提升。尽管EC的粘度更高且离子电导率更低,但含有50 vol.% EC的水系电解液中锌沉积过电位显著低于使用较低体积比DEC的水系电解液体系。这表明在使用EC作为共溶剂的水系电解液中,可能存在一种独特的组分相互作用机制。
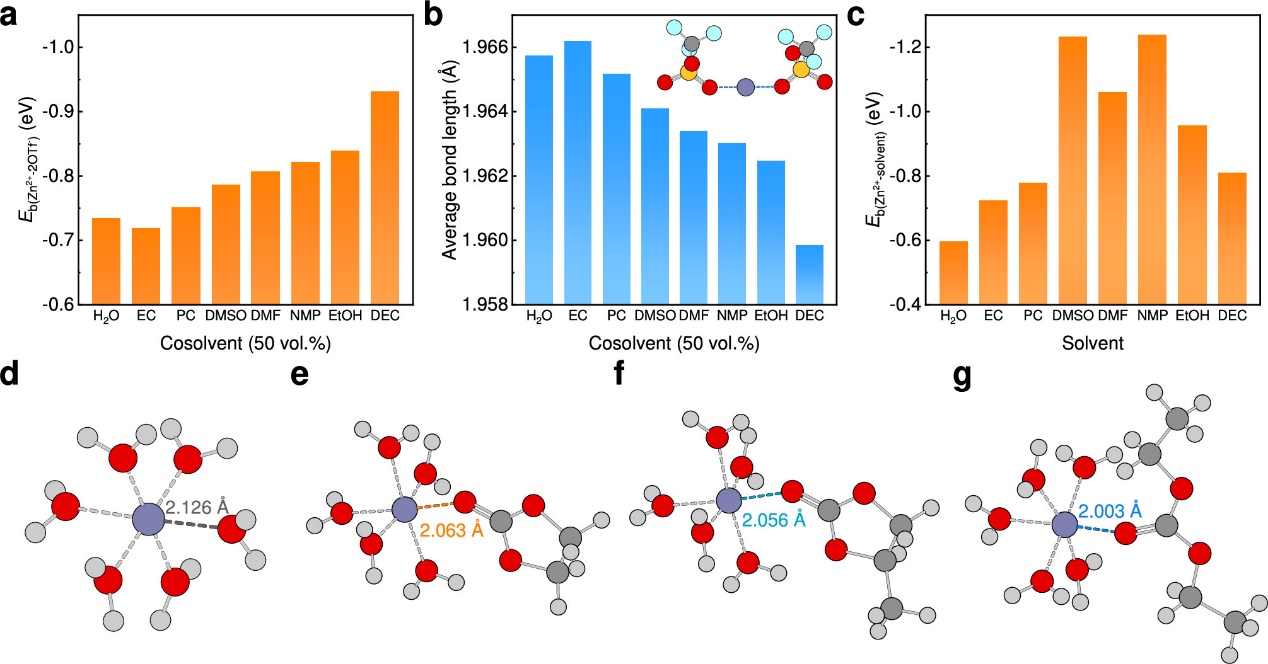
图2. 组分间的相互作用。(a)在纯水溶剂或含有50体积%不同共溶剂的混合水系溶剂中,一个Zn2+与两个OTf-之间的结合能。(b)在纯水溶剂或含有50体积%不同共溶剂的混合水系溶剂中,一个Zn2+与两个OTf-配位氧原子之间的平均键长。(c)Zn2+与溶剂分子之间的结合能。(d-f)Zn2+与(d)EC、(e)PC和(f)DEC的配位氧原子之间的键长。在球棍模型中,原子的颜色为:氢,浅灰色;碳,深灰色;氧,红色;锌,蓝灰色。
引入具有高介电常数的EC可有效削弱Zn2+与OTf-之间的离子对相互作用,引入其他介电常数较低的有机溶剂则会增强Zn2+与OTf-之间的离子对相互作用。
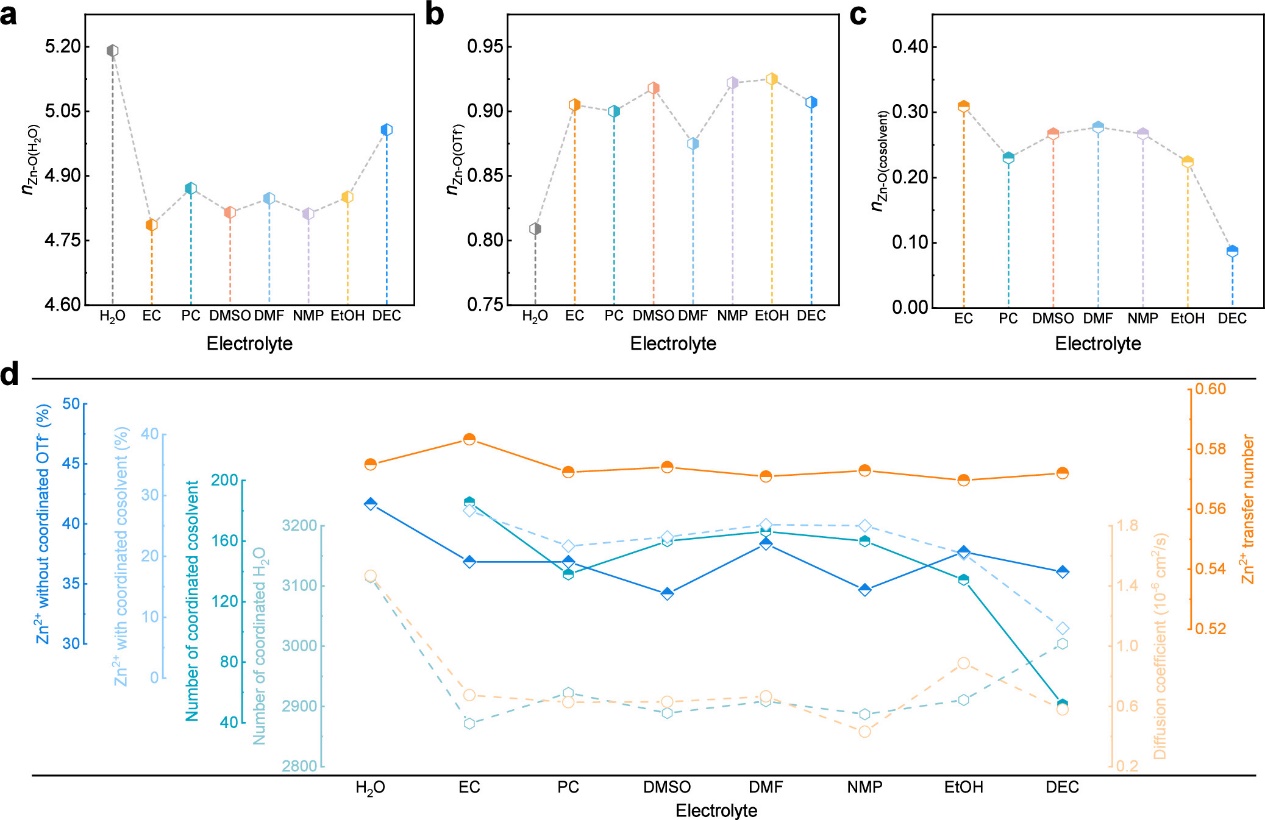
图3. 溶剂化结构的差异。(a-c)Zn2+第一溶剂化壳层中相应分子/离子的配位数:(a)H2O,(b)OTf-和(c)共溶剂。(d)根据MD结果,溶剂化环境与Zn2+动力学性质之间的关系图。坐标轴按梯度高度显示,每条轴对应相同颜色的折线图。
共溶剂在Zn2+第一溶剂化鞘层中的配位比例与混合溶剂的介电常数之间不存在线性相关性。这一现象表明,共溶剂参与Zn2+第一溶剂化鞘层的能力不仅取决于介电常数,还受到分子体积和配位基团类型等多种因素的共同影响。与纯水系电解液相比,含共溶剂的水系电解液中离子的扩散系数显著降低,这证实了共溶剂的引入不可避免地会导致电解液的动力学性能下降。然而,通过合理选择共溶剂类型可以优化电解液的动力学性能:引入EtOH能够有效降低对Zn2+扩散系数的影响,而添加EC则有助于提高Zn2+的迁移数。
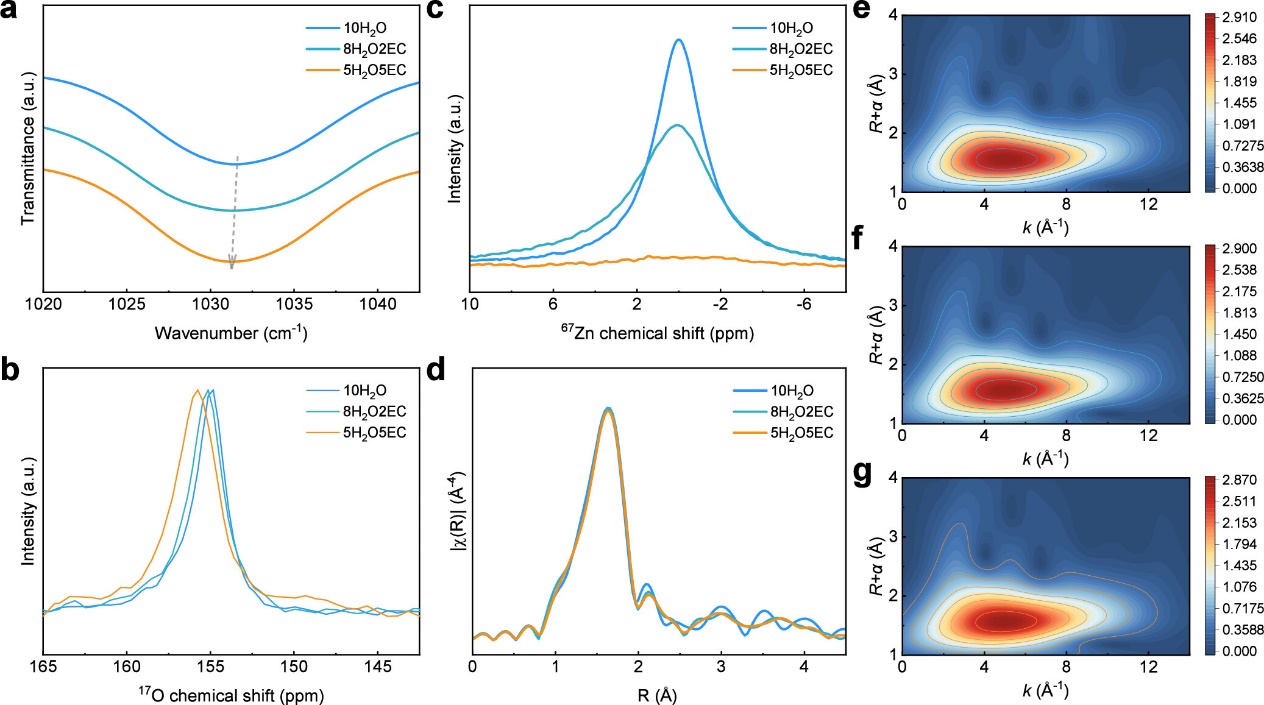
图4. EC对水系电解液的影响。(a)不同电解液的FTIR光谱。(b)不同电解液的17O NMR光谱。(c)不同电解液的67Zn NMR光谱。(d)Zn K边的EXAFS光谱。(e-g)Zn K边的小波变换:(e)10H2O,(f)8H2O2EC和(g)5H2O5EC。

图5. 电解液和锌负极的电化学性能。(a)在5.0 mA cm-2和1.0 mAh cm-2条件下,Zn/Zn电池的循环性能。(b)在5.0 mA cm-2和1.0 mAh cm-2条件下,Zn/Cu电池的循环性能。(c)在含有50体积% EC的水系电解液中,Zn/Cu电池的对应电压曲线。(d)在纯水系电解液中沉积的锌表面的HRTEM图像。(e)在含有50体积% EC的水系电解液中沉积的锌表面的HRTEM图像。(f)沉积锌表面的STEM图像和EDS元素分布图。
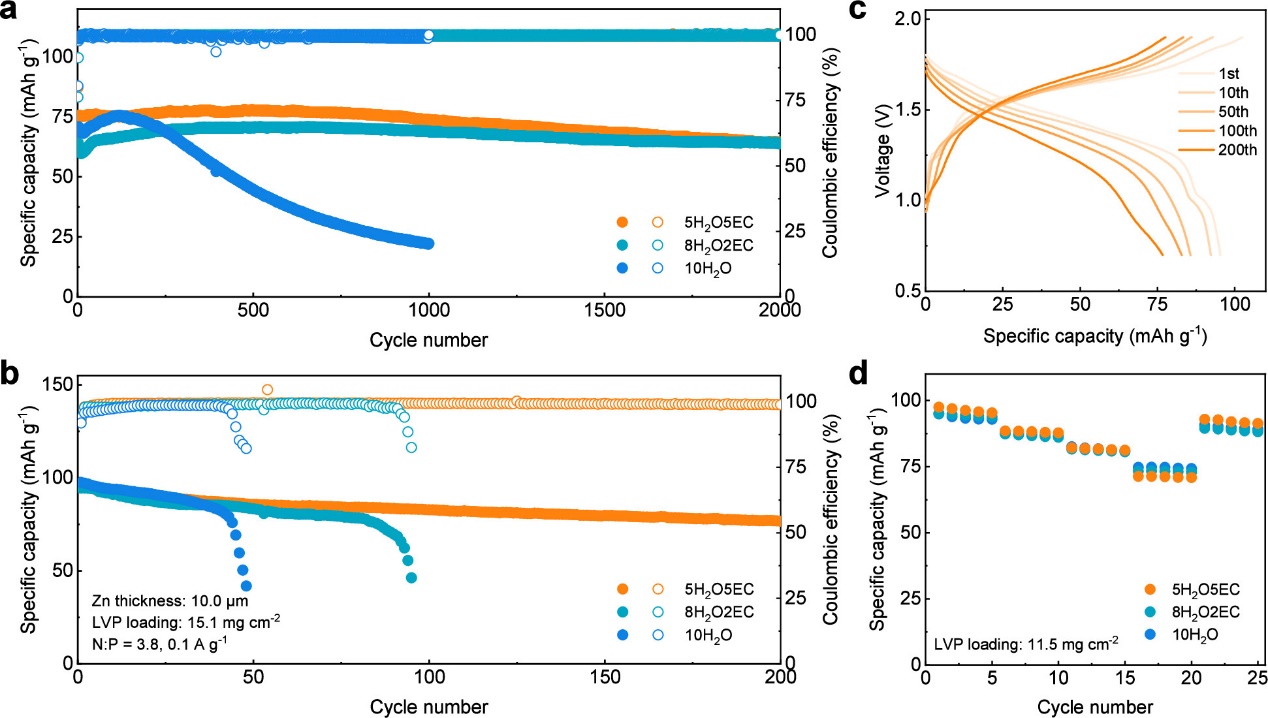
图6. 全电池的电化学性能。(a)在1.0 A g-1条件下,Zn/LVP全电池的循环性能。(b)在0.1 A g-1条件下,Zn/LVP全电池的循环性能。(c)在含有50体积% EC的水系电解液中,Zn/LVP全电池的对应电压曲线。(d)Zn/LVP全电池的倍率性能。电流密度分别为0.1、0.2、0.3、0.5、1.0 A g-1。
尽管引入EC不可避免地导致离子电导率降低,但采用具有动力学补偿机制的水系电解液的Zn/LVP全电池在较高充放电倍率下仍能保持与纯水系电解液极为接近的放电比容量。
【研究结论】
本研究提出了一种水系锌电池共溶剂电解液策略中的动力学补偿机制,该机制可以通过引入高介电常数的共溶剂来削弱阴阳离子对之间的相互作用并提高迁移数,从而补偿因引入共溶剂导致的动力学性能损失。以含有EC的基于Zn(OTf)2的水性电解液作为模型体系,验证了这种共溶剂电解液策略在实现水系锌电池动力学补偿的同时提升其电化学性能的有效性。这一策略也适用于其他具有类似性质的共溶剂以及其他水系电池体系。
【文献链接】
Kinetics Compensation Mechanism in Cosolvent Electrolyte Strategy for Aqueous Zinc Batteries.