【文章内容】
我们设计了四种 "4S"(单盐和单溶剂)WSE来研究界面化学。通过反应力场揭示了SEI的厚度、孔隙体积和孔隙率。结果显示,杂环和对称的四氢吡喃在锂-金属电池系统中具有最合适的溶解力和最好的界面稳定性。这项研究为弥合分子热力学和界面化学的差距提供了一条弱溶解性电解质的设计路线。该成果以题为“Eco-Friendly Tetrahydropyran Enables Weakly Solvating “4S” Electrolytes for Lithium-Metal Batteries”发表在国际知名期刊Advanced Energy Materials上。
【研究背景】
锂枝晶的生长阻碍了锂金属电池的商业应用。电解质在影响电极/电解质界面化学方面起着关键作用。传统的电解质采用强溶解性溶剂来溶解锂盐,形成富含有机物的固体电解质界面(SEI)。富含有机物的SEI的Li+ 导电性和机械强度都很差,所以衍生的SEI不能有效地抑制Li枝晶的生长。弱溶剂化电解质(WSE)系统可以实现无机富集SEI,显示出与锂金属更好的兼容性。然而,WSE的设计规则并不明确。
【研究亮点】
一、本工作采用四种不同的醚,DME、2-MeTHF、THP和1,4-DX,来构建 "4S "WSE。系统地分析了溶剂化结构以及它们与SEI结构的关系。
二、结果发现DME(典型的线性醚)在四种醚中具有最强的溶解能力,不是WSE溶剂的好选择;2-MeTHF、THP和1,4-DX(环状醚)可以作为弱溶解的溶剂。其中,THP在锂金属电池体系中的表现最好。THP具有环状对称结构,降低了C-O-C键中O原子的电子密度,导致分子的溶解力降低。因此,阴离子可以更多地参与溶剂化壳,在金属锂上产生富含LiF的SEI。
三、使用基于THP的电解质的Li/Cu半电池显示出较高的库仑效率(99.2%)和超过720次循环的卓越循环稳定性。即使在苛刻的测试条件下(10 mg cm−2 的磷酸铁锂(LFP)和20 µm的锂箔),LFP/锂软包电池在140次循环后表现出85%的高容量保持率。
四、此外,为了深入了解SEI结构,ReaxFF MD被用来分析金属锂负极和电解质之间的SEI形成。通过使用优化的Connolly探针方法,显示了SEI的关键特征(厚度、孔隙率、孔隙体积)。此外,与广泛使用的氟化弱溶解性溶剂不同,THP要便宜得多,而且可以大规模地生产。THP也是环境友好的:它可以自发地被生物降解,并且是唯一无毒和无致癌性的
【图文导读】
广泛使用的锂离子电池主要采用SSE,其中大多数Li+ 与溶剂分子配位,在Li+ 周围产生一个基于SSIPs的溶剂化壳。与自由溶剂分子相比,溶剂化壳中的溶剂分子更容易被还原,形成SEI的有机成分(如ROCO2Li,ROLi)。富含有机物的SEI是无定形的,在循环过程中很容易被Li枝晶穿透。一旦锂枝晶产生,由于锂枝晶上的电流密度较高,Li+往往会沉积在锂枝晶上。因此,在没有自我修复的情况下,锂枝晶的生长会进一步恶化(图1)。至于WSE,阴离子部分占据了配位点,而不是溶剂分子。因此,占主导地位的Li+ 溶剂化壳从SSIPs变为CIPs/AGG。阴离子在溶剂化壳中的参与减少了还原溶剂分子的数量,促进了SEI中无机相(如LiF、Li2O)的含量。富含无机物的SEI有利于调节均匀的Li+ 通量和电流分布,导致均匀的Li沉积。同时,电解质和金属锂之间的寄生反应被减少。因此,金属锂电池的循环稳定性可以得到改善。

图1. 强溶解性电解质和弱溶解性电解质的示意图介绍
一般来说,线性醚比环状醚显示出更强的溶解力。这里,一个线性醚(DME)、三个环状醚(2-MeTHF、THP和1,4-DX)和七种锂盐(LiPF6 , LiOTf, LiTFSI, LiFSI, LiDFOB, LiBF4 ,和LiBOB)分别被用来构建 "4S "电解质。研究了所得到的"4S "电解质与锂金属阳极的兼容性。除了LiBOB,所有的锂盐都可以完全溶解在DME、2-MeTHF和THP中。由于介电常数低,1,4-DX只能溶解LiFSI,这与其他研究一致。2-MeTHF和THP的结果也与最近的报道在预锂化反应过程中一致。LiFSI是弱溶解性醚的最佳选择。当采用LiFSI作为锂盐时,可以达到很高的Li//Cu电池库仑效率(98.6% LiFSI/2-MeTHF;98.8% LiFSI/THP;98.2% LiFSI/1,4-DX),远远高于其他盐。其原因可能是LiFSI的S-F键很容易断裂,为SEI创造LiF。因此,在接下来的研究中,LiFSI被选为单一盐类。
图2a显示了通过密度泛函理论(DFT)计算的不同分子和团簇的HOMO(最高占位轨道)/LUMO(最低未占位轨道)能量,这可以表明一个分子的电压窗口。低LUMO意味着电解质容易在阳极表面形成SEI,而高HOMO意味着分子很可能在阴极一侧被氧化。四个自由醚分子(DME、2-MeTHF、THP和1,4-DX)的HOMO/LUMO能量分别为-5.71/1.32、-5.36/1.40、-5.55/1.47和-5.41/1.55 eV。很明显,环状醚具有更好的抗还原能力。当vs. Li+ 连接时,LUMO能级下降,表明配位复合物更容易被还原。因此,减少Li+ 和溶剂之间的连接可以抑制溶剂分子的还原。还计算了FSI− 阴离子和LiFSI盐的HOMO和LUMO能级。可以看出FSI− vs. Li+ 连接后更容易被还原。醚的静电势(ESP)被进一步计算,如图2b所示。所有醚分子中的O原子都提供了负电荷密度,表明Li+ 更倾向与O原子结合。很明显,O原子的电子密度在环状和对称醚(THP和1,4-DX)中较小。负电荷密度越低,表明Li+ 与溶剂的联系越弱。图2c显示了Li+ -溶剂组的结合能:Li+ -DME, Li+ -2-MeTHF, Li+ -THP, Li+ -1,4-DX, 分别为-1.56, -1.48, -1.50, 和 -1.40 eV。计算电荷密度差以阐明Li+ 和溶剂之间的关系(图2d)。电子从O转移到Li+ ,更多的电子转移表示更稳定的配合。极性O原子中较低的电子导致了较弱的溶解力。上述DFT结果表明,环状和对称的醚类拥有Li+ 的弱溶解力。
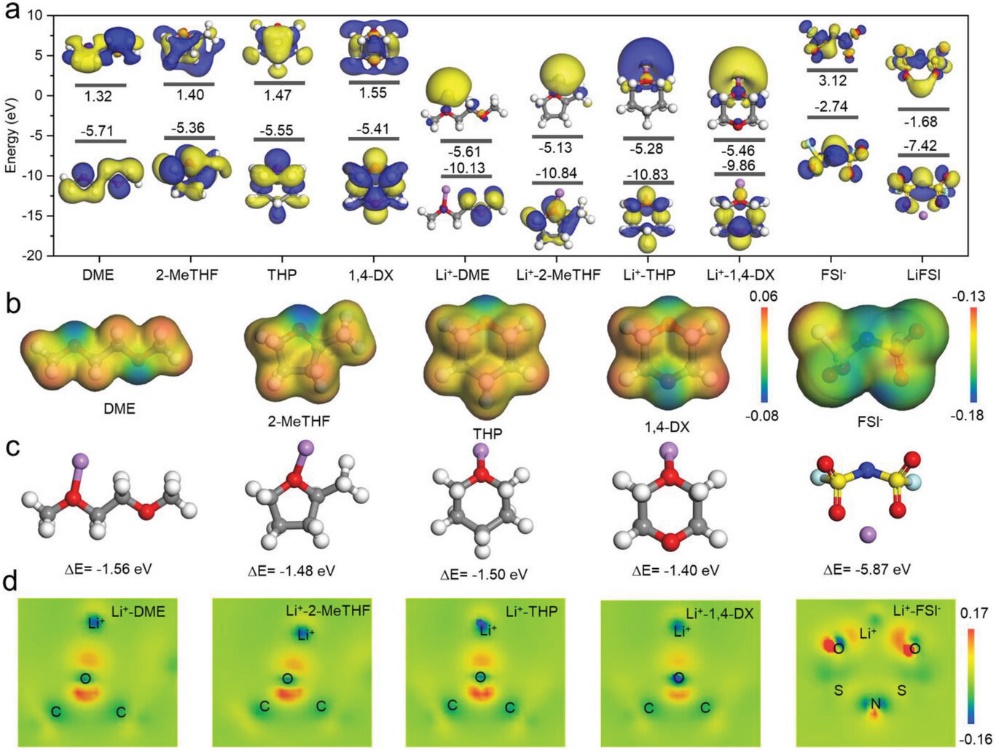
图2. a) 不同分子和团簇的HOMO和LUMO能级;b) DME、2-MeTHF、THP、1,4-DX和FSI− 的ESP;c) 结合能 d) Li+ -DME、Li+ -2-MeTHF、Li+ -THP、Li+ -1,4-DX和Li+-FSI− 的不同电子密度。
根据上述结果,四个 "4S "电解质分别以LiFSI为单一盐和醚为单一溶剂进行设计。在0.5/1/1.5/2 M盐浓度下,DME、2-MeTHF、THP和1,4-DX电解质的电子电导率分别显示为9.07/15.78/17.65/16.56、1.31/3.02/4.03/4.41、1.28/3.17/3.92/4.08和0.52/1.69/2.71/3.00 mS cm−1 。虽然溶解力下降,但WSE的电导率仍然可以接受(>1.0 mS cm−1 )。电导率的降低表明LiFSI的解离度降低。考虑到成本问题,本工作中的锂盐浓度为1M。
基于THP的电解质表现出最高的tLi+ 。测试表明,DME的还原电位最高,为0.45V,而2-MeTHF为0.43V,THP为0.42V,而1,4-DX为0.41V。一旦溶剂减少,金属锂的表面就被钝化,避免了其他副反应。由于THP的低粘度,电解质拥有最快的传输动力学。进行核磁共振光谱测试以分析电解质的溶剂化结构。由于Li+ 周围的电子密度增加,当Li+ 与阴离子和溶剂连接时,7Li 的化学峰将向上移动。基于2-MeTHF、THP和1,4-DX的系统比基于DME的电解质表现出较少的上移。这一结果可能是由于二甲醚分子中的O具有很强的溶解能力,这增加了Li+周围的电子密度。
MD模拟被用来研究电解质的溶剂化结构(图3a-d)。根据径向分布函数(RDF)和配位数(n)的分析结果(图3e-h),溶解能力按从DX、THP、2-MeTHF到DME的顺序增加,而第一溶解剂鞘中阴离子的比例相应减少。四种电解质中的经典溶剂化基团可以记录为Li+[FSI]−0.11[DME]2.2,Li+[FSI]−0.57[2-MeTHF]2.6 ,Li+[FSI ]−0.59[THP]2.6 ,以及Li+[FSI]−0.45[1,4-DX]1.8 。Li+ 扩散系数是通过拟合Li+ 位移的均方来计算的,基于二甲醚的电解质显示出最高的Li+ 扩散系数。
拉曼分析是为了进一步验证四种电解质的溶剂化结构。观察到FSI− 和溶剂的S-N-S(720 cm−1 )和Li-溶剂拉伸振动。FSI− 拉曼峰显示,基于2-MeTHF、THP和1,4-DX的电解质比基于DME的电解质拥有更多的CIPs和AGG(图3i-l)。溶剂的溶解能力可以由分子的路易斯碱值来定义:Li+ 拥有路易斯酸性,与电子负性的O原子相连。此外,通过紫外-可见光谱来计算路易斯基值。DME、2-MeTHF、THP和1,4-DX的Kamlet-Taft路易斯基性(β)分别被计算为0.038、-0.061、-0.11和-0.27。因此,O原子的低刘易斯基数意味着Li+-溶剂的联系很弱。
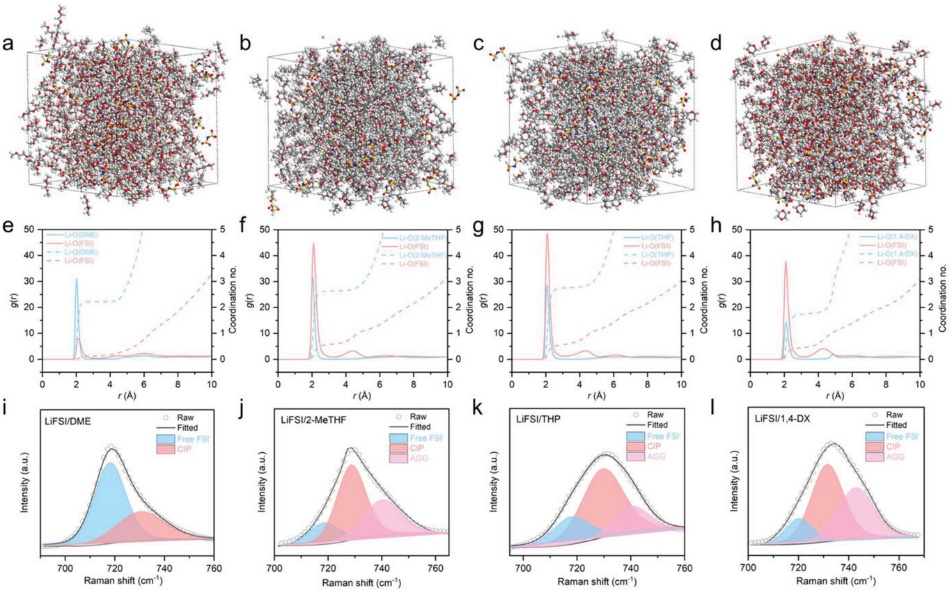
图3. 电解质的分子动力学模拟:a)LiFSI/DME;b)LiFSI/2-MeTHF;c)LiFSI/THP;d)LiFSI/1,4-DX。不同电解质的自由基分布函数:e)LiFSI/DME;f)LiFSI/2-MeTHF;g)LiFSI/THP;h)LiFSI/1,4-DX。电解质的拉曼光谱:i) LiFSI/DME; j) LiFSI/2-MeTHF; k) LiFSI/THP; l) LiFSI/1,4-DX。
SEI的多孔结构在决定锂阳极/电解质界面的结构稳定性方面起着关键作用。然而,由于SEI的内在复杂性和环境敏感性,直接观察和定量分析非常困难。2023年,反应力场(ReaxFF)首次被用于刺激SEI。可以采用Connolly方法对SEI的多孔结构进行定量分析。这里,利用ReaxFF进行分子动力学(MD),模拟四个 "4S "电解质的SEI的动态形成过程(图4a)。高活性的金属锂与电解质反应,引发了SEI的形成。弱溶解性的电解质减少了锂的迁移并防止了副反应。随着反应时间的增加,SEI覆盖了金属锂的表面,并且提取的SEI厚度逐渐稳定。图4b-e显示了平均Li电荷分布谱。金属锂和Li+ 的电荷分别为0和1。根据电荷分布,可以模拟出SEI的厚度。在DME、2-MeTHF、THP和1,4-DX的电解质中,SEI的厚度分别为38.4、25.6、23.3和33.1 Å。图4f-i直观地显示了四种电解质下SEI的多孔结构演变。在生长阶段,SEI是相对稀疏的,有更多的孔和大部分的通孔,这也解释了由于电解质和阳极之间通过通孔的直接反应,SEI在早期阶段有较快的生长速度。随着不溶性成分的不断积累,孔隙很难增加,SEI变得密集。由于图像表示选择xz平面来比较SEI孔隙的变化,所以在四种电解质下SEI孔隙的差异仍然表现出来。据统计,在DME、2-MeTHF、THP和1,4-DX四种电解质下,100ps的孔隙体积分别为3024、1972、1552和2301 Å3 ,表明基于THP的电解质使SEI的孔隙减少。此外,四个不同的电解质下的孔隙体积和孔隙率变化表明,THP中的SEI具有最少的孔隙,这意味着最密集的结构。可以推测,THP衍生的SEI具有最好的传输能力和结构稳定性。
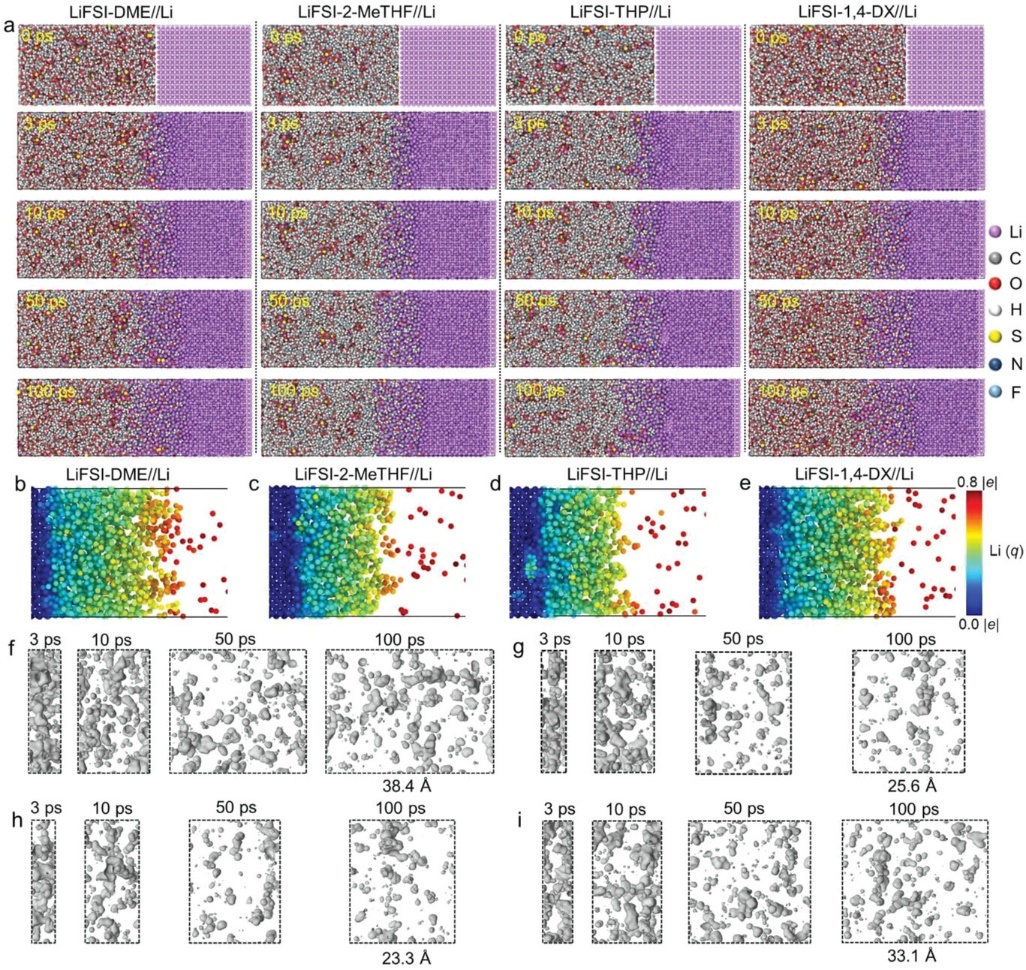
图4. a) 电解质中SEI动态形成模拟的视觉模型。b)LiFSI-DME//Li;c)LiFSI-2-MeTHF//Li;d)LiFSI-THP//Li;f)LiFSI-1,4-DX//Li的电极/电解质区中锂原子的电荷分布谱。(f) LiFSI-DME//Li; g) LiFSI-2-MeTHF//Li; h) LiFSI-THP//Li; i) LiFSI-1,4-DX//Li中的SEI在t = 3, 10, 50和100 ps时的孔结构演变。
图5a-h显示了在1 mA cm−2 电流密度和4 mAh cm−2 容量下的锂沉积的形态。在LiFSI/DME电解质中,观察到许多面条状的沉积物,表明沉积的锂的生长是不规则和多孔的。当溶剂被2-MeTHF、THP或1,4-DX取代时,锂膜的孔隙率明显下降。在LiFSI/THP体系中的锂膜表现出最均匀的表面,没有明显的孔隙,验证了锂枝晶生长受到抑制。从截面上看,沉积的锂膜的厚度分别为42、34、28和40μm(图5e-h)。较低的厚度表明孔隙率较低,可以更有效地抑制活性锂和电解质之间的副反应。剥离后的锂膜的形态也被观察到。在LiFSI/DME电解质中的铜箔上出现了许多死锂。相比之下,LiFSI/THP电解质中的铜箔显示出最干净的表面,显示出金属锂的优良可逆性。原位光学Li/Li电池被组装起来,以直接观察Li的生长过程。很明显,在DME、2-MeTHF和1,4-DX电解质中,锂的枝晶随着时间的增加而增长,而在THP电解质中的锂箔则保持平坦的结构,验证了锂的密集沉积(图5i)。

图5. 不同电解质中沉积的锂膜的形态和厚度 a,e) LiFSI/DME; b,f) LiFSI/2-MeTHF; c,g) LiFSI/THP; d,h) LiFSI/1,4-DX. i) 原位Li/Li电池中1 mA cm−2 ,沉积的锂的数字图像。每个图像的平均时间为≈2分钟。比例尺为100µm。
XPS测试被用来分析各种电解质中SEI的化学组成(图6)。在F 1s光谱中≈685和687 eV的峰分别代表C-F和Li-F键。在C 1s光谱中,C-C/C-H、C-O、C = O和C-F键分别为290、286.4、288.9和284.7 eV。根据峰面积的差异,在LiFSI/DME电解质中,SEI含有许多有机相(如ROCO2Li)和少量无机材料(LiF)。THP电解质中LiF的含量高于其他三种电解质。图6i-l中还显示了表面下不同深度的元素分布。发现一个有趣的结果,DX基电解质中的内极性有机物(ROLi、ROCO2Li)低于2-MeTHF、THP电解质。Li+溶剂化结构和SEI化学成分是锂沉积的两个关键因素。更多的FSI− 阴离子参与到第一个溶剂化壳中,有望形成无机物丰富的SEI。不仅是无机相(如LiF),而且一些极性有机物(如ROCO2Li)也很重要。无机相可以促进Li+ 转移,而有机物可以保证灵活的SEI,适合循环过程中Li的体积膨胀。
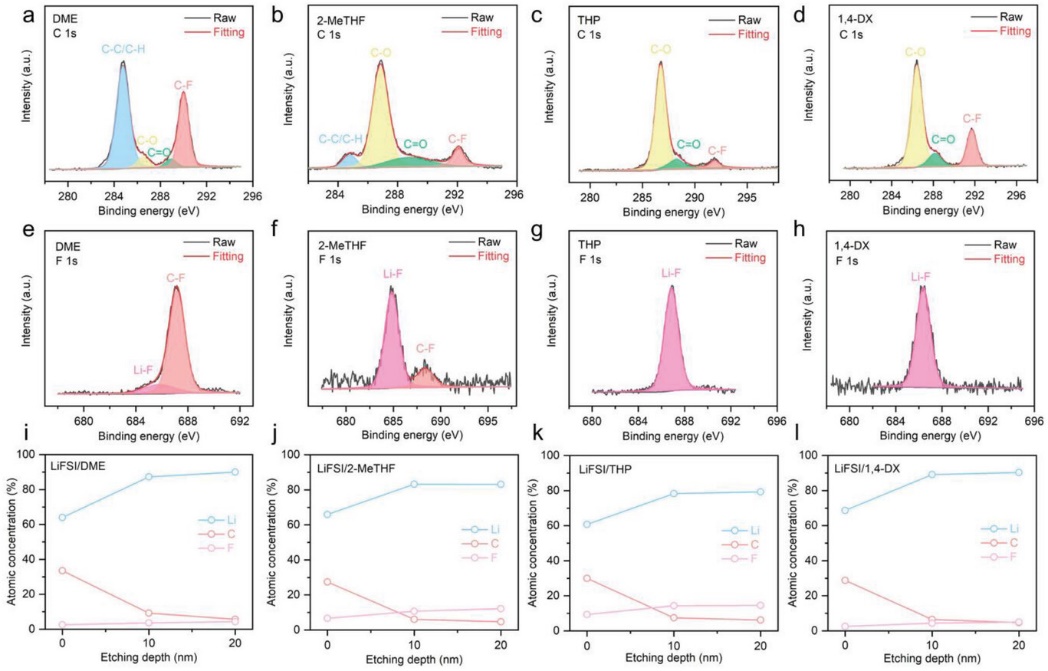
图6. SEI层的化学成分和元素浓度:a,e,i) LiFSI/DME;b,f,j) LiFSI/2-MeTHF;c,g,k) LiFSI/THP;d,h,l) LiFSI/1,4-DX。金属锂阳极/电解质界面的动态模拟:m) LiFSI/DME; n) LiFSI/2-MeTHF; o)LiFSI/THP; p) LiFSI/1,4-DX.
锂/铜电池被组装起来,以评估不同 "4S "电解质与金属锂的兼容性。如图7a所示,使用DME电解质的电池的平均库仑效率为97.5%,低于其他电解质(98.8%,2-MeTHF;99.2%,THP;98.2%,1,4-DX)。使用THP电解质的电池可以稳定地循环720次以上。当沉积的锂容量增加到4 mAh cm−2 ,THP电池仍然可以保持200次循环(图7b)。优秀的循环稳定性表明,THP是四种醚中最好的锂金属阳极溶剂。
制作了10μm的锂箔与高质量负载的LFP阴极(10mgLFP cm−2 )配对(图7c)的全电池,对应于苛刻的N/P比例为1.2。使用基于THP的电解质的Li/LFP全电池在180次循环后显示出最高的容量保持率,即93.3%,对应于每个循环的容量衰减率为0.036%。
最后,采用超声波扫描技术来监测循环过程中软包电池的气体产生和电解质分布。气体的产生与电解质和金属锂之间的寄生反应有关。更多的气体表明有更多的副反应。如图7e-l所示,使用基于二甲醚的电解质的电池图显示出最宽的蓝色区域,意味着循环后最大的气体生成。相比之下,使用THP电解质的电池图几乎是绿色的,显示出最稳定的电解质/锂界面。
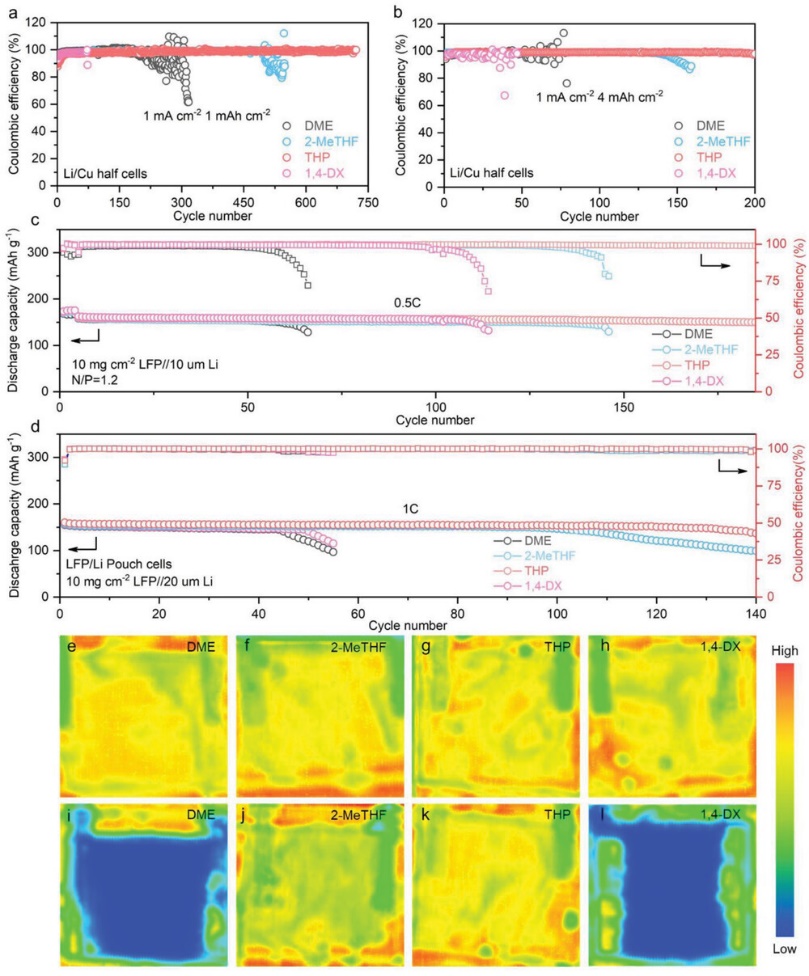
图7 循环性能,50次循环之后的软包电池的超声波图像。
【结论】
综上所述,本工作提出了四种基于线性DME、循环2-MeTHF、THP和1,4-DX的 "4S "电解质用于锂金属电池。其中,环状对称的THP显示出与锂阳极的最高兼容性,在低盐浓度(1M)下可以大幅促进CIPs和AGG。DFT计算证实,THP与Li+的结合能比DME弱。MD模拟表明,更多的FSI− 阴离子参与到第一个Li+ 的溶剂化鞘中。最后,在THP电解质中实现了富含LiF的SEI。此外,ReaxFF MD显示,THP-电解质中自由生长的SEI是薄而致密的,可以有效地抑制Li枝晶的生长。因此,SEI的形成结构从溶剂引起的化学反应转变为阴离子引起的界面化学反应。因此,采用THP电解质的Li/LFP软包电池在2.3的低N/P比例下显示出长期循环稳定性。此外,THP不致癌,不形成过氧化氢,并且可以生物降解,有希望实现环境友好。我们的WSE设计比其他WSE系统更便宜。这项工作为下一代锂离子电池提供了一个精确和生态友好的电解质设计。通过调节溶剂化结构,WSE可以成为实现锂金属电池的一种简便而高效的方法。
【文献链接】
Eco-Friendly Tetrahydropyran Enables Weakly Solvating “4S” Electrolytes for Lithium-Metal Batteries